| 「禁忌を含む注意事項等情報」等はこちらをご参照ください。 |
ORION-9(海外第Ⅲ相検証試験、海外データ):
HeFH患者にレクビオを投与したときの有効性及び安全性を評価する試験
併用されているスタチンは、国内承認範囲外の用法及び用量が含まれます。併用薬についての用法及び用量等詳細は、各製品の電子添文をご確認ください。
Day510のLDL-Cのベースラインからの変化率 [主要評価項目(co-primary endpoint)(検証的な解析結果)]
主要評価項目(co-primary endpoint)(検証的な解析結果)
Day510のLDL-Cのベースラインからの変化率(ITT集団)

欠測値は、多重代入法(multiple imputation washout model)により補完した。補完後のデータセットに対して、投与群を固定効果、ベースラインのLDL-C値を共変量とした共分散分析(ANCOVA)を適用し、Rubinの方法により併合した。
*:有意差あり(両側p値<0.05)
社内資料:海外第Ⅲ相試験(ORION-9)(CTD2.7.6-4.1.1)[20230062][承認時評価資料]
Raal FJ, et al. N Engl J Med 2020; 382(16): 1520-1530[20230048]
[利益相反]本研究はMedicines Companyから資金提供を受けた。著者のうち3名はMedicines Companyの社員であり、同社のストックオプションを保有していた。
その他にMedicines Company又はノバルティスからコンサルタント料、顧問料、謝礼金等の支援を受領した者が含まれる。
Day90後Day540までのLDL-Cのベースラインからの期間平均変化率 [主要評価項目(co-primary endpoint)(検証的な解析結果)]
主要評価項目(co-primary endpoint)(検証的な解析結果)
Day90後Day540までのLDL-Cのベースラインからの期間平均変化率(ITT集団)
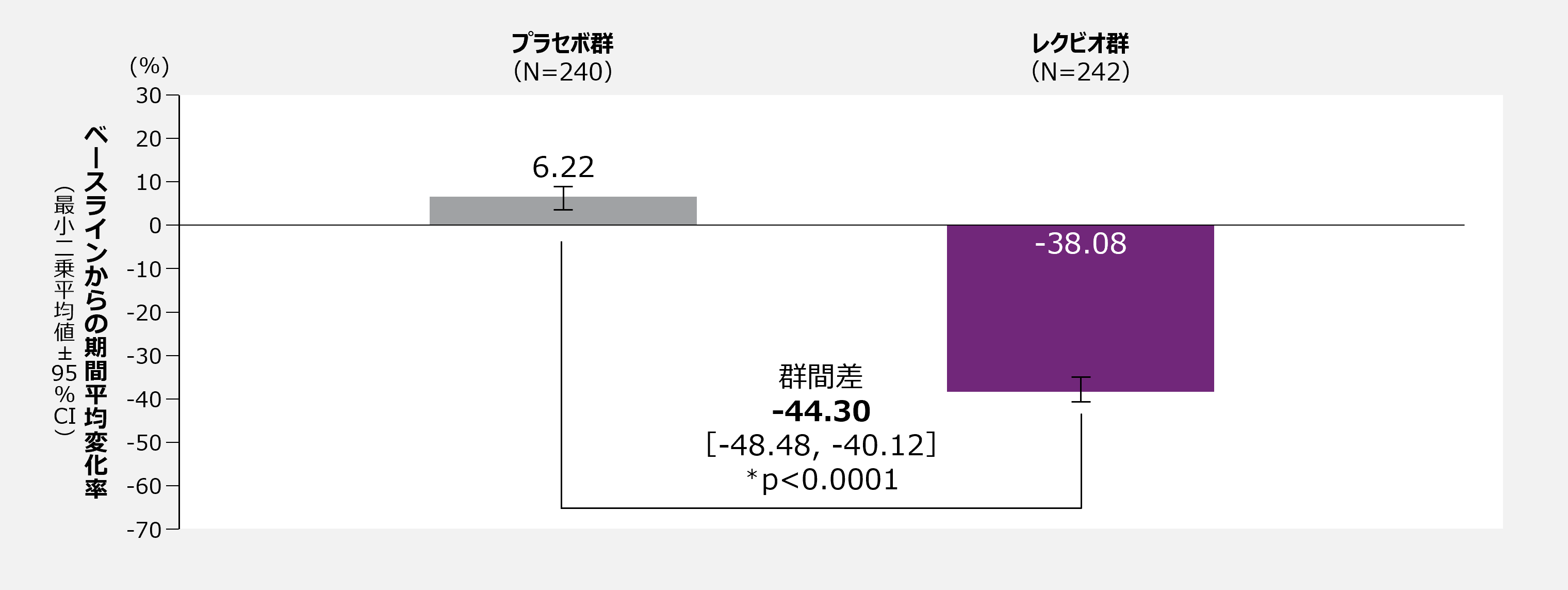
欠測値は、多重代入法(control-based pattern mixture model)により補完した。補完後のデータセットに対して、投与群、評価時点、投与群と評価時点の交互作用を固定効果、ベースラインのLDL-C値を共変量としたMMRMを適用し、Rubinの方法により併合した。
*:有意差あり(両側p値<0.05)
社内資料:海外第Ⅲ相試験(ORION-9)(CTD2.7.6-4.1.1)[20230062][承認時評価資料]
Raal FJ, et al. N Engl J Med 2020; 382(16): 1520-1530[20230048]
[利益相反]本研究はMedicines Companyから資金提供を受けた。著者のうち3名はMedicines Companyの社員であり、同社のストックオプションを保有していた。
その他にMedicines Company又はノバルティスからコンサルタント料、顧問料、謝礼金等の支援を受領した者が含まれる。
Day510のLDL-Cのベースラインからの絶対変化量 [主な副次評価項目(検証的な解析結果)]
主な副次評価項目(検証的な解析結果)
Day510のLDL-Cのベースラインからの絶対変化量(ITT集団)

最小二乗平均値[95%CI]
欠測値は、多重代入法(control-based pattern mixture model)により補完した。補完後のデータセットに対して、投与群、評価時点、投与群と評価時点の交互作用を固定効果、ベースラインのLDL-C値を共変量としたMMRMを適用し、Rubinの方法により併合した。
*:有意差あり(両側p値<0.05)
社内資料:海外第Ⅲ相試験(ORION-9)(CTD2.7.6-4.1.1)[20230062][承認時評価資料]
Raal FJ, et al. N Engl J Med 2020; 382(16): 1520-1530[20230048]
[利益相反]本研究はMedicines Companyから資金提供を受けた。著者のうち3名はMedicines Companyの社員であり、同社のストックオプションを保有していた。
その他にMedicines Company又はノバルティスからコンサルタント料、顧問料、謝礼金等の支援を受領した者が含まれる。
Day540までの各評価時点におけるLDL-Cのベースラインからの変化率
Day540までの各評価時点におけるLDL-Cのベースラインからの変化率
その他の副次評価項目
Day90、150、270、330、450、540のLDL-Cのベースラインからの変化率(ITT集団)
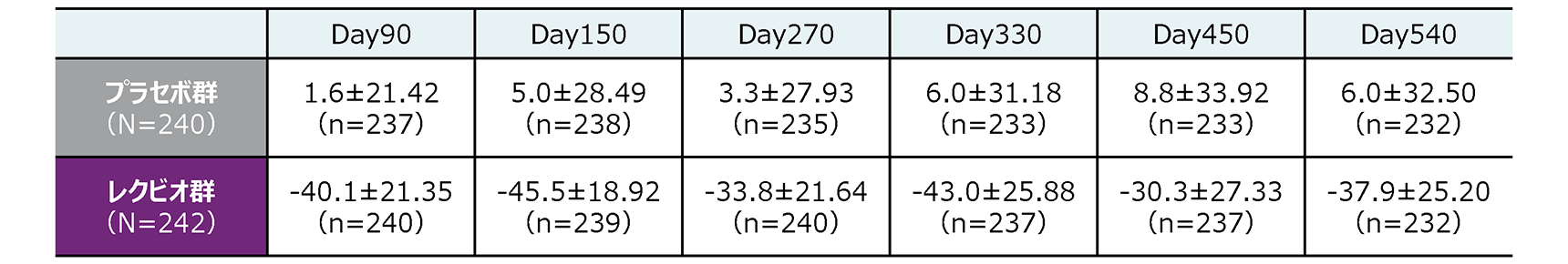
平均値±標準偏差(%)
n:ベースライン及び該当する評価時点の検査値が欠測ではない被験者数
社内資料:海外第Ⅲ相試験(ORION-9)(CTD2.7.6-4.1.1)[20230062][承認時評価資料]
Raal FJ, et al. N Engl J Med 2020; 382(16): 1520-1530[20230048]
[利益相反]本研究はMedicines Companyから資金提供を受けた。著者のうち3名はMedicines Companyの社員であり、同社のストックオプションを保有していた。
その他にMedicines Company又はノバルティスからコンサルタント料、顧問料、謝礼金等の支援を受領した者が含まれる。
参考
各評価時点におけるLDL-Cのベースラインからの変化率の推移(ITT集団)
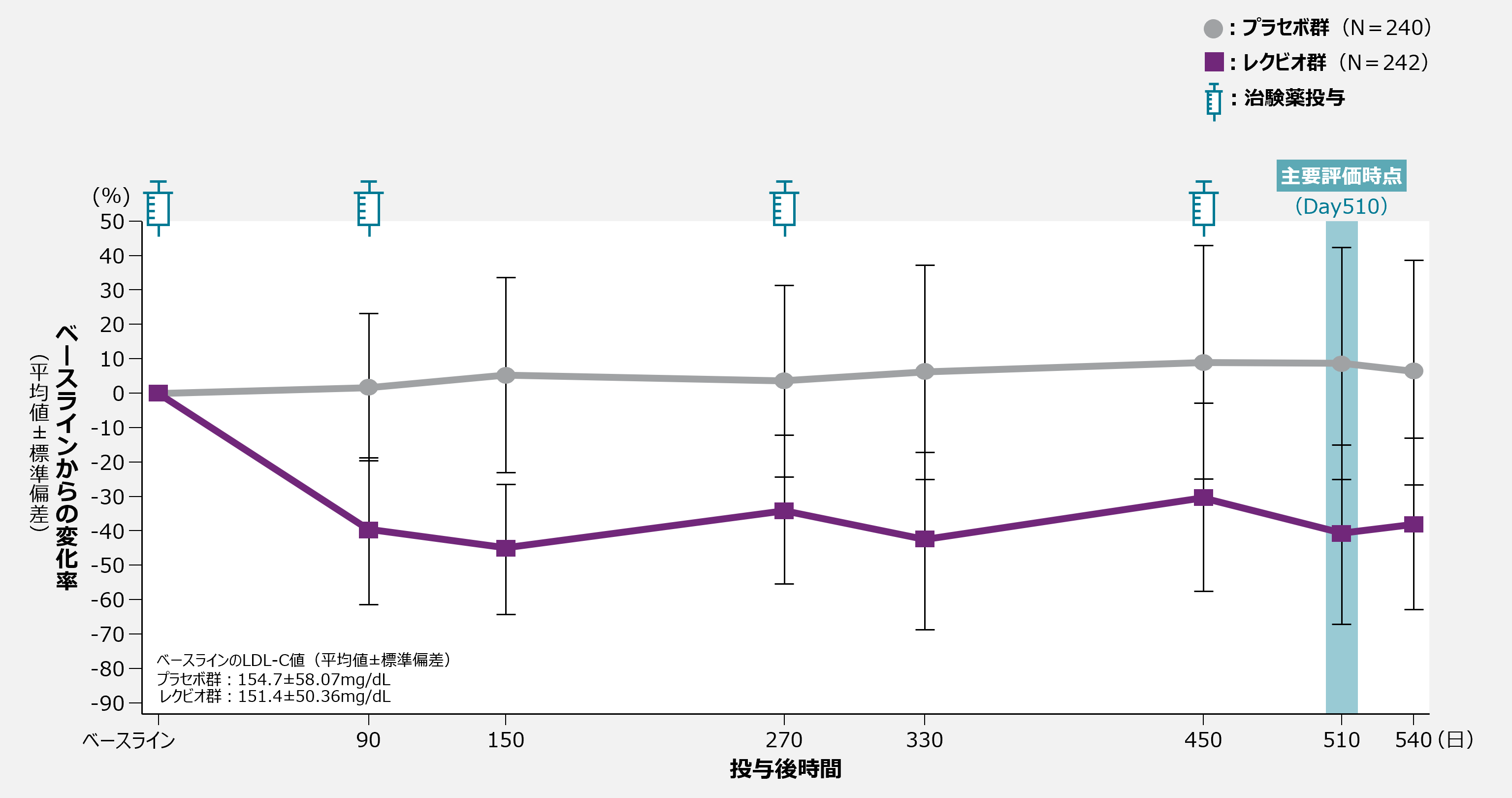
社内資料:海外第Ⅲ相試験(ORION-9)(CTD2.7.6-4.1.1)[20230062][承認時評価資料]
Raal FJ, et al. N Engl J Med 2020; 382(16): 1520-1530[20230048]
[利益相反]本研究はMedicines Companyから資金提供を受けた。著者のうち3名はMedicines Companyの社員であり、同社のストックオプションを保有していた。
その他にMedicines Company又はノバルティスからコンサルタント料、顧問料、謝礼金等の支援を受領した者が含まれる。
安全性(SAF)
ORION-9における副作用は、プラセボ群(N=240)及びレクビオ300mg群(N=241)において、それぞれ10例(4.2%)及び58例(24.1%)に認められました。いずれかの群で1.0%以上に発現した副作用(基本語別)は、注射部位反応が0例(0.0%)及び22例(9.1%)、注射部位紅斑が0例(0.0%)及び9例(3.7%)、注射部位そう痒感が1例(0.4%)及び6例(2.5%)、注射部位疼痛が0例(0.0%)及び6例(2.5%)、注射部位発疹が0例(0.0%)及び3例(1.2%)でした。投与中止に至った副作用はレクビオ300mg群(N=241)において、2例(0.8%)に認められました。内訳は注射部位反応、咳嗽が各1例でした。重篤な副作用、死亡に至った副作用は両群において認められませんでした。
ORION-91、2)
家族性高コレステロール血症ヘテロ接合体(HeFH)患者にレクビオを投与したときの有効性及び安全性を評価する試験
1)社内資料:海外第Ⅲ相試験(ORION-9)(CTD2.7.6-4.1.1)[20230062][承認時評価資料]
2)Raal FJ, et al. N Engl J Med 2020; 382(16): 1520-1530[20230048]
[利益相反]本研究はMedicines Companyから資金提供を受けた。著者のうち3名はMedicines Companyの社員であり、同社のストックオプションを保有していた。
その他にMedicines Company又はノバルティスからコンサルタント料、顧問料、謝礼金等の支援を受領した者が含まれる。
試験概要
目的
HeFH患者を対象に、レクビオ300mgを皮下投与したときの有効性、安全性、及び忍容性を評価する。
試験デザイン
多施設共同、第Ⅲ相、プラセボ対照、二重盲検、ランダム化試験
対象
HeFH患者
症例数
ランダム化例数:482例(プラセボ群:240例、レクビオ群:242例)
ITT集団※1:482例(プラセボ群:240例、レクビオ群:242例)
安全性解析対象集団(SAF)※2:481例(プラセボ群:240例、レクビオ群:241例)
※1 ランダム化されたすべての被験者。 ※2 治験薬を1回以上投与されたすべての被験者。
主な選択基準
- 18歳以上の男女の患者。
- 遺伝子検査でHeFHと診断されたことのある患者。若しくは、未治療時のLDL-Cが190mg/dLを超え、かつ、家族性高コレステロール血症(FH)の家族歴、若しくはFHが示唆される高コレステロール血症又は早発性冠動脈疾患の家族歴を有する患者。
- 米国National Cholesterol Education Program等の低脂肪食を安定して摂取している患者。
- スクリーニング時のLDL-Cが2.6mmol/L(100mg/dL)以上の患者。
- スクリーニング時の空腹時トリグリセリドが4.52mmol/L(400mg/dL)未満の患者。
- 標準的な臨床的方法で算出されたeGFRが30mL/分を超える患者。
- スタチンを使用中の患者の場合は、スタチンを最大耐用量で使用していなければならない。最大耐用量とは、忍容できない有害事象が発現することなく、スタチンを定期的に使用できる最大用量と定義する。
- スタチンを使用中でない患者の場合は、2種類以上のスタチンのあらゆる用量に対して不耐であったことが記録されていなければならない。
- 脂質低下剤を使用中の患者の場合は、その用量がスクリーニングの30日以上前から一定であり、試験参加期間中は薬剤変更及び用量変更の予定がない。
主な除外基準
スクリーニング前90日以内に抗PCSK9抗体による治療を受けた患者。
投与方法
被験者をプラセボ群又はレクビオ群のいずれかに1:1でランダム化し、プラセボ又はレクビオ300mgをDay1、90、270、450に皮下投与した。
基礎治療は抗PCSK9抗体を除く脂質低下剤とし、スタチンは最大耐用量を投与することとした。試験期間中は用法及び用量を一定とした。
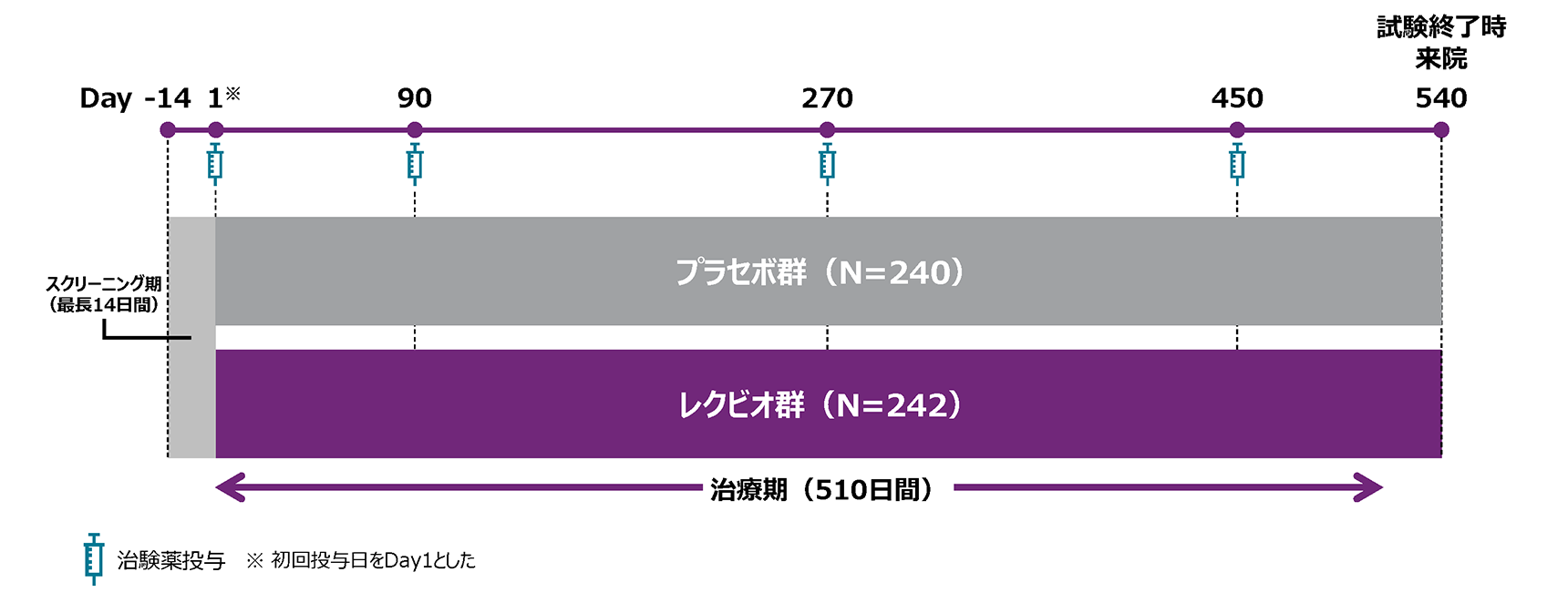
主要評価項目(co-primary endpoint)
- Day510のLDL-Cのベースラインからの変化率(検証的な解析項目)
- Day90後Day540までのLDL-Cのベースラインからの期間平均変化率(検証的な解析項目)
副次評価項目
【主な副次評価項目】
- Day510のLDL-Cのベースラインからの絶対変化量(検証的な解析項目)等
【その他の副次評価項目】
- Day90、150、270、330、450、540のLDL-Cのベースラインからの変化率
- レクビオの安全性及び忍容性 等
解析計画
【主要評価項目】
2つの主要評価項目(co-primary endpoint)の仮説検定では、仮説全体での第一種の過誤率αを、α=0.05(両側)に制御した。Day510のLDL-Cのベースラインからの変化率について、α=0.05(両側)で帰無仮説が棄却され、レクビオのプラセボに対する優越性が示された場合は、Day90後Day540までのLDL-Cのベースラインからの期間平均変化率をα=0.05(両側)で検証することとした。
- Day510のLDL-Cのベースラインからの変化率
欠測値は、多重代入法(multiple imputation washout model)により補完した。補完後のデータセットに対して、投与群を固定効果、ベースラインのLDL-C値を共変量とした共分散分析(ANCOVA)を適用し、Rubinの方法により併合した。 - Day90後Day540までのLDL-Cのベースラインからの期間平均変化率
欠測値は、多重代入法(control-based pattern mixture model)により補完した。補完後のデータセットに対して、投与群、評価時点、投与群と評価時点の交互作用を固定効果、ベースラインのLDL-C値を共変量とした反復測定混合効果モデル(MMRM)を適用し、Rubinの方法により併合した。
【主な副次評価項目】
主な副次評価項目の解析は、2つの主要評価項目の検定を終えて帰無仮説が棄却された場合にのみ実施した。主な副次評価項目の比較では、第一種の過誤率を、Hochberg法を用いてα=0.05(両側)に制御した。解析方法は、主要評価項目と同様の解析方法とした。
【その他の副次評価項目】
投与群別の記述的及びグラフによる要約を示した。
患者背景(ITT集団)
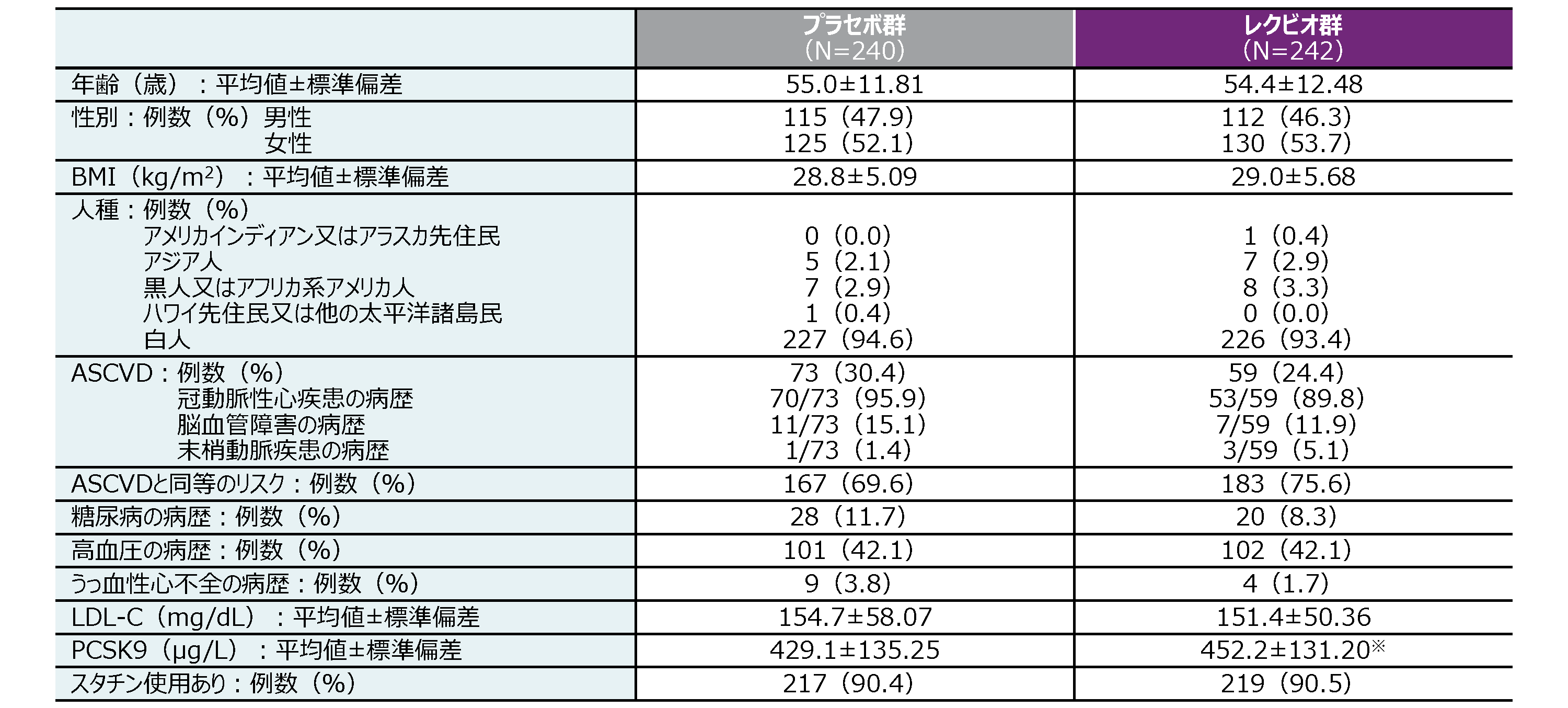
※ n=241
n:ベースラインの検査値が欠測ではない被験者数
臨床試験